Schlaue Moleküle verschliessen Wunden.
Text: Angelika Jacobs
Bei einer schweren Verletzung kann der Körper die Blutung kaum selbst stillen. Künstliche Moleküle sollen helfen, die Blutgerinnung zu verbessern.
Ein Unfall. Schwerer Blutverlust. In der Notaufnahme muss es schnell gehen. Mit kleinen Verletzungen kommt der Körper gut zurecht: Mit der Blutgerinnung hat er ein ausgeklügeltes System, um Wunden zu verschliessen. Bei starker Blutung gelingt es dem Organismus aber nicht, am entscheidenden Ort ausreichend Gerinnungsfaktoren aufzubieten. Es kann sich kein Blutpfropf bilden, der den Blutfluss stillt. Das medizinische Personal kann nachhelfen, und zwar mit Gerinnungsfaktoren, die aus gespendetem Blut isoliert und im Notfall verabreicht werden. «Diese Faktoren zu isolieren ist allerdings teuer, sie sind nicht lange haltbar und wirken auch nicht besonders effizient», sagt Michael Nash.
Mit seinem Forschungsteam entwickelt der Professor für Molecular Engineering smarte Moleküle, die sich in den körpereigenen Gerinnungsmechanismus einklinken können. Ziel ist, den Blutpfropf zu verstärken, um eine Verletzung schneller und stabiler zu schliessen – nicht nur bei schweren Wunden, sondern auch bei erblich bedingten Gerinnungsstörungen oder wenn die Einnahme von blutverdünnenden Medikamenten die Gerinnung hemmt.
Plättchen und Fasernetz
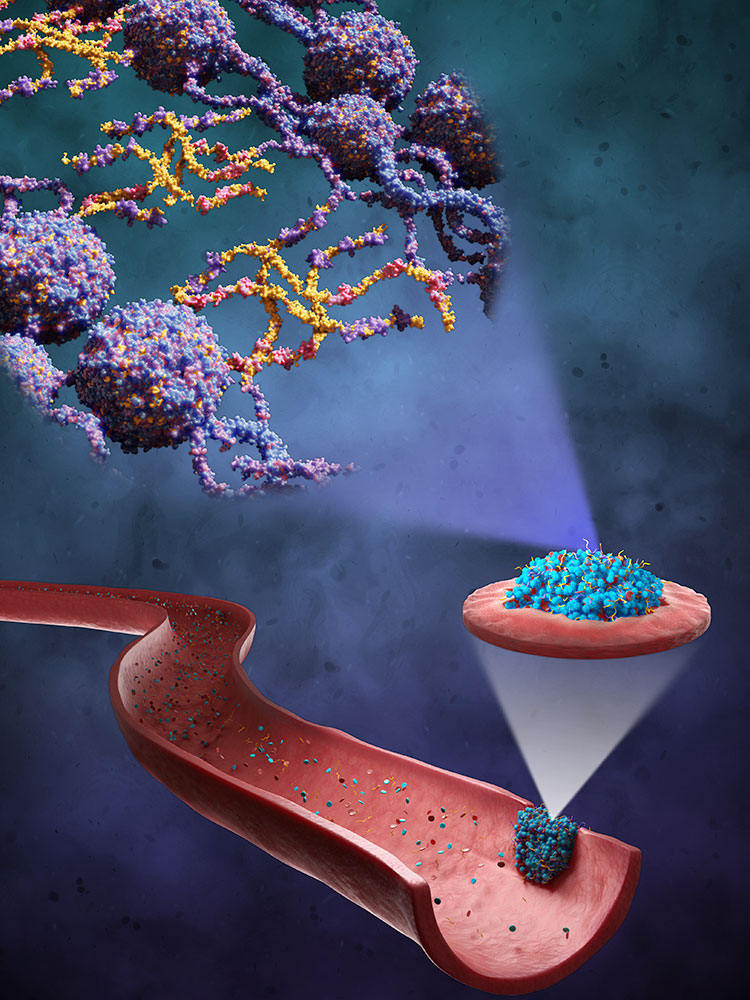
Blutet eine Wunde, verändert sich dadurch der Blutfluss, und dieser mechanische Reiz gibt den Blutplättchen das Signal, sich an der verletzten Stelle zu sammeln. Die Plättchen schütten wiederum einen Botenstoff aus, der die Bildung eines Netzwerks aus sogenannten Fibrinfasern anregt. Blutplättchen und Fibrinnetz verbinden sich zu einem Blutpropf, der die Wunde verschliesst.
«Dieser Pfropf hat interessante mechanische Eigenschaften: Je mehr Zug auf ihn ausgeübt wird, desto steifer wird er», so Nash. Das steht im Gegensatz zur Alltagserfahrung, dass ein elastischer Gegenstand wie eine Zugfeder seine Struktur verliert, wenn er zu stark beansprucht wird: Die Feder bricht irreversibel und kann sich nicht mehr elastisch zusammenziehen oder ausdehnen. Der Blutpfropf hingegen wird sozusagen stabiler, je stärker die Kräfte sind, die das Blut auf ihn ausübt.
Diese besonderen Eigenschaften will Nashs Team noch verstärken. Dafür arbeiten sie mit Makromolekülen, die aus elastischen Proteinbaustein-Ketten bestehen. Fachleute nennen sie «Elastin-ähnliche Polypeptide» (ELPs). Im Zuge eines vom Europäischen Forschungsrat ERC geförderten Projekts hat Nashs Forschungsgruppe diese ELPs so weiterentwickelt, dass die körpereigenen Gerinnungsfaktoren am Ort der Verletzung sie erkennen und ins Fibrinnetzwerk mit einbauen.
Wie Öl in Wasser
Doch nicht nur das: Durch einen weiteren Trick verbessern diese Moleküle die Gerinnung noch zusätzlich. Aufgrund ihres speziellen Designs verändern die ELPs beim Überschreiten einer bestimmten Temperaturschwelle ihre Eigenschaften. Bei Raumtemperatur sind sie wasserlöslich und lassen sich so für den späteren Gebrauch gut lagern. In der Umgebungstemperatur des Körpers von etwa 37 Grad werden sie jedoch hydrophob: Wie Öl in Wasser, das sich in Tröpfchen sammelt, ballen sich die ELPs zu Nanopartikeln zusammen, wodurch sie länger im Blut zirkulieren können und stabil bleiben. Zudem fördert diese starke Anreicherung an ELPs in Nanopartikeln ihre chemische Vernetzung mit den Fibrinfasern.
In Laborversuchen konnten Nash und seine Mitarbeitenden beobachten, dass diese speziellen Eigenschaften der designten Makromoleküle dazu führen, dass der Blutpfropf ein dünneres, aber gleichzeitig dichteres und steiferes Geflecht aufweist und dadurch stabiler wird. Zudem wird der so modifizierte Pfropf von Enzymen des Körpers langsamer abgebaut, was die Wundheilung in bestimmten Fällen verbessern könnte. Inzwischen ist die Entwicklung zum Patent angemeldet; nun sollen präklinische Studien an Versuchstieren folgen.
Mechanische Fühler
Was die Forschenden im Rahmen der Blutgerinnung erforschen und entwickeln, bettet sich ein in ein grösseres Thema: Die Stabilität von Makromolekülen, wie sie auch immer mehr in der Medizin eingesetzt werden; mehrheitlich Antikörper und Enzyme. Neben dem Design von Makromolekülen als mögliche Therapeutika erforscht das Team auch natürliche Phänomene, die als Inspiration für die Eigenschaften dieser neuen Moleküle dienen könnten. Dabei stehen Reaktionen auf mechanische Reize im Mittelpunkt, wie etwa das erwähnte Signal für den Beginn der Blutgerinnung. «Wie genau Proteine mechanische Reize wahrnehmen und verarbeiten, ist ein noch kaum erforschtes Feld», so Nash.
So gibt es in der Welt der Eiweisse beispielsweise Mechanismen, durch die ein Protein sich unter Zugkraft stärker an einem Objekt «festkrallt», an das es bindet. Kürzlich konnte das Basler Forschungsteam einen solchen Mechanismus bei Darmbakterien beschreiben, die sich trotz der starken Scherkräfte im Verdauungstrakt an Cellulosefasern festhalten können.
Solche Tricks der Natur liessen sich womöglich auch in Biopharmazeutika einbauen, die dann auf mechanische Reize reagieren und beispielsweise ihre Funktionsweise ändern. Nützlich wären solche Eigenschaften beispielsweise für Nanopartikel, die sich trotz starkem Blutfluss in Tumoren festklammern sollten. «Biomoleküle so zu designen, dass sie spezifisch an bestimmten Strukturen, Geweben oder Zellen haften: Das wird der Schlüssel zur Entwicklung zielgerichteter Therapien sein, die nur dort wirken, wo sie benötigt werden, aber den Rest des Organismus schonen», so Nash abschliessend. «Wir sind gespannt, wohin unser Ansatz uns führen wird.»
Weitere Artikel in der aktuellen Ausgabe von UNI NOVA.